CARBOHIDRATOS
En animales y plantas, los carbohidratos poliméricos funcionan como moléculas almacenadoras de energía. Los animales pueden ingerir carbohidratos, que a continuación se puedan oxidar para obtener energía para los procesos metabólicos. También se encuentran carbohidratos poliméricos en las paredes celulares y en los recubrimientos protectores de muchos organismos; otros carbohidratos polímeros son moléculas marcadoras que permiten que un tipo de célula reconozca e interaccione con otro tipo.
LOS AZÚCARES EN EL CAMPO DE LA FARMACOLOGÍA
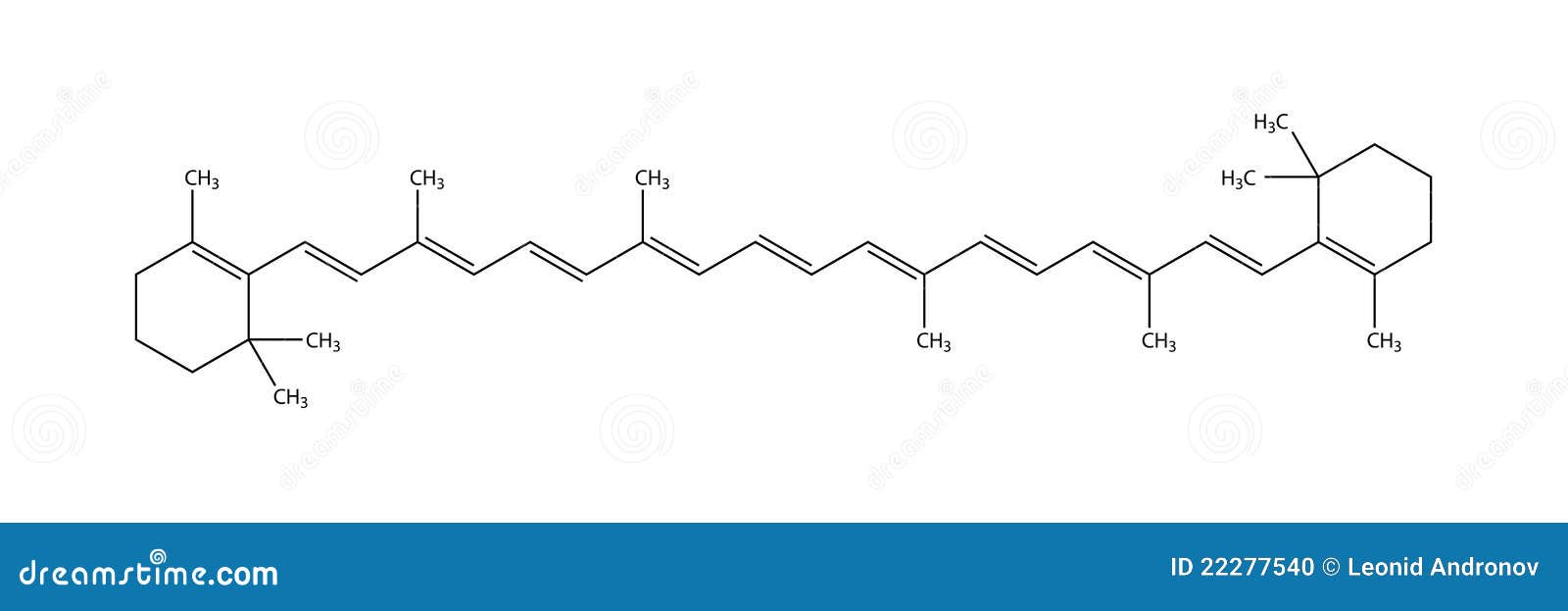
| ÁCIDO SIÁLICO (ÁCIDO N-ACETILNEURAMÍNICO) |
El primer azúcar (glúcido) usado en terapéutica fue la heparina (década de 1930). La mayoría de los preparados continúan obteniéndose partiendo del intestino de bóvidos. Las primeras preparaciones eran muy heterogéneas porque cada fabricante tenía su propio procedimiento de aislamiento y purificación. Charles Best comenzó a usar preparados de heparina para transfusiones de sangre en una época inmediatamente anterior a la Segunda Guerra Mundial. Además, la heparina hizo factible el desarrollo de la hemodiálisis (1944); y, algunos años más tarde, la cirugía de by–pass. Sin embargo los preparados de heparina no solo variaban entre distintos fabricantes, sino incluso entre diferentes lotes de un mismo laboratorio. Ello generó la necesidad de una normalización, para lo cual se desarrolló un estándar internacional.
Alrededor de 1968 se desarrollaron en Francia las heparinas de bajo peso molecular, si bien su introducción en la práctica clínica se pospuso más de dos décadas. Los nuevos preparados, más específicos en sus dianas farmacológicas, pero sobre todo con un patrón de efectos adversos más favorable, tampoco lograban lotes homogéneos. Cuando se redacta este artículo (septiembre, 2011) no se ha establecido un estándar internacional que normalice los distintos preparados.
Algunos Fármacos con Carbohidratos:
OPTISOURCE Sabor café
| Compuesto del fármaco: BIOTINA |
¿Qué es la biotina?
Posiblemente hayas oído hablar de la biotina, pero no sabes que es exactamente. Esta es una vitamina fundamental que debemos aportar a nuestro organismo para metabolizar grasas, hidratos de carbono y aminoácidos.
A su vez, la biotina, conocida también como Vitamina B8, B7 o Vitamina H, se encarga de transformar la glucosa en energía, mantener saludables celulas de tejidos como la piel, el cabello o las uñas, así como la creación de hemoglobina. Como vemos es muy importante tener un aporte de Biotina correcto.
Debido a estas propiedades beneficiosas, la biotina se emplea en diferentes tratamientos, como por ejemplo la diabetes de tipo II, la dermatitis seborreica y en especial en tratamientos para el cabello con biotina, utilizando champús y comprimidos para paliar la debilidad del pelo y su posterior caída.
 |
| Estructura del Resource: Vit. D3 |
Se pueden describir los carbohidratos por la cantidad de unidades monómeras que contienen.
- Los monosacáridos son las unidades más pequeñas de estructura de carbohidratos. El nombre carbohidrato, “hidrato de carbono”, indica que su fórmula empírica es (CH2O)n, donde n es 3 o más (en general n es 5 o 6, pero puede ser hasta 9).
- Los oligosacáridos son polímeros con dos hasta unos 20 residuos de monosacárido. Los oligosacáridos más comunes son los disacáridos, formados por dos residuos de monosacárido unidos.
- Los polisacáridos son polímeros que contienen muchos (en general más de 20) residuos de monosacárido. Los oligosacáridos y los polisacáridos no tienen la fórmula empírica (CH2O)n, porque durante la formación del polímero se elimina agua.
La mayor parte de los monosacáridos son compuestos quirales
Los monosacáridos son sólidos blancos, cristalinos y solubles en agua que tienen sabor dulce. Entre los ejemplos están la glucosa y la fructosa. Desde el punto de vista químico, los monosacáridos son polihidroxi aldehídos o aldosas, o polihidroxi cetonas o cetosas.
Los monosacáridos más pequeños son triosas, azúcares con tres carbonos. Los compuestos con uno o dos carbonos que tienen la fórmula general (CH2O)n no tienen las propiedades típicas de los carbohidratos (como sabor dulce y la capacidad de cristalizar).
Se puede considerar que las aldosas y las cetosas más largas son prolongaciones del gliceraldehído y la dihidroxiacetona, respectivamente, y que los grupos quirales H—C—OH están insertados entre el carbono carbonílico y el grupo alcohol primario. La figura 8.3 muestra la lista completa de los nombres y estructuras de las tetrosas (aldosas de cuatro carbonos), pentosas (aldosas de cinco carbonos) y hexosas (aldosas de seis carbonos) relacionadas con el D-gliceraldehído.
La mayor parte de los enantiómeros D son los que se sintetizan en las células vivas, y sólo los enantiómeros L de los aminoácidos son más comunes. En consecuencia, no se muestran los enantiómeros L de las 15 aldosas.El gliceraldehído, aldosa con tres carbonos, sólo tiene un átomo quiral (C-2) y en consecuencia sólo dos estereoisómeros. Las aldotetrosas tienen cuatro estereoisómeros (D- y L-eritrosa y D- y L-treosa), porque tanto la eritrosa como la treosa poseen dos átomos de carbono quirales. En general, hay 2nestereoisómeros posibles de un compuesto que tenga n carbonos quirales. Las aldohexosas, que tienen cuatro carbonos quirales, tienen un total de 24 o 16 estereoisómeros (las ocho D aldohexosas y sus enantiómeros L). Cuando las moléculas de azúcar tienen distinta configuración sólo en uno de varios centros quirales, se llaman epímeros. Por ejemplo, la D-manosa y la D-galactosa son epímeros de la D-glucosa (en C-2 y C-4, respectivamente), aunque no son epímeros entre sí.
¿Qué son los excipientes?

Los excipientes son los componentes del medicamento diferentes del principio activo (sustancia responsable de la actividad farmacológica). Éstos se utilizan para conseguir la forma farmacéutica deseada (cápsulas, comprimidos, soluciones, etc.) y facilitan la preparación, conservación y administración de los medicamentos. Ejemplos:
Aglutinantes (binders): mantienen los ingredientes de una tableta unidos. Comúnmente se utilizan almidones, azúcares y celulosas como Hidroxipropil celulosa o lactosa. También se utilizan azúcares alcohólicas como xilitol, sorbitol o maltitol.
Los excipientes son los componentes del medicamento diferentes del principio activo (sustancia responsable de la actividad farmacológica). Éstos se utilizan para conseguir la forma farmacéutica deseada (cápsulas, comprimidos, soluciones, etc.) y facilitan la preparación, conservación y administración de los medicamentos. Ejemplos:
Aglutinantes (binders): mantienen los ingredientes de una tableta unidos. Comúnmente se utilizan almidones, azúcares y celulosas como Hidroxipropil celulosa o lactosa. También se utilizan azúcares alcohólicas como xilitol, sorbitol o maltitol.
 |
| Hidroxipropil celulosa |
XILITOL
Rellenos (Fillers): rellenan el contenido de una pastilla o cápsula para lograr una presentación conveniente para el consumo. La celulosa vegetal es un relleno cuyo uso es bastante extendido en tabletas o cápsulas de gelatina dura. El fosfato de calcio dibásico es también un relleno popular para tabletas. Para cápsulas de gelatina blanda suele utilizarse flor de cártamo.
Desintegradores (disintegrants): estos se expanden y disuelven cuando se les moja, así causando que la tableta se rompa en el tracto digestivo y libere los principios activos para su absorción.
| fosfato de calcio dibásico |
Conformaciones de los monosacáridos
Debido a su simplicidad, las proyecciones de Haworth se usan con frecuencia en bioquímica. Esas fórmulas muestran la configuración de los átomos y los grupos en cada átomo de carbono de la columna vertebral del azúcar. Sin embargo, la geometría de los átomos de carbono de un anillo de monosacárido es tetraédrica (ángulos de enlace cercanos a 110°), por lo que en realidad los anillos de monosacárido no son planos.
Derivados de los monosacáridos
Los monosacáridos, en las vías metabólicas, con frecuencia se convierten en ésteres de fosfato. En la figura 8.13 se muestran las estructuras de varios fosfatos de azúcar con los que se encontrará al estudiar el metabolismo de los carbohidratos.
B. Desoxiazúcares
En la figura 8.14 se muestran las estructuras de dos desoxiazúcares. En esos derivados, un átomo de hidrógeno sustituye a uno de los grupos hidroxilo del monosacárido precursor. La 2-desoxi-D-ribosa es un bloque constructivo importante en el ADN.
C. Aminoazúcares
En varios azúcares, un grupo amino sustituye uno de los grupos hidroxilo del monosacárido precursor. A veces el grupo amino está acetilado. Los aminoazúcares de la glucosa y la galactosa se suelen presentar en glucoconjugados. El ácido N-acetilneuramínico (NeuNAc) se forma a partir de la N-acetilmanosamina y piruvato.
D. Azúcares alcoholes
En un azúcar alcohol el oxígeno carbonílico del monosacárido precursor se ha reducido y se produce un polihidroxialcohol. La figura 8.16 muestra tres ejemplos de azúcares alcoholes. La glicerina y el mio-inositol son componentes importantes de los lípidos.
E. Azúcares ácidos
Los azúcares ácidos son ácidos carboxílicos derivados de las aldosas, sea por oxidación de C-1 (el carbono aldehídico) para formar un ácido aldónico, o por oxidación del carbono con número mayor (el que tiene el alcohol primario) para formar un ácido aldurónico.
F. Ácido ascórbico
El ácido L-ascórbico, o vitamina C, es un enodiol de una lactona derivada del D-glucoronato. Los primates no pueden convertir glucoronato en ácido ascórbico, y en consecuencia deben obtenerlo en su dieta. El ácido ascórbico es un cofactor esencial para las enzimas que catalizan la hidroxilación de los residuos de prolina y lisina durante la síntesis de colágena.
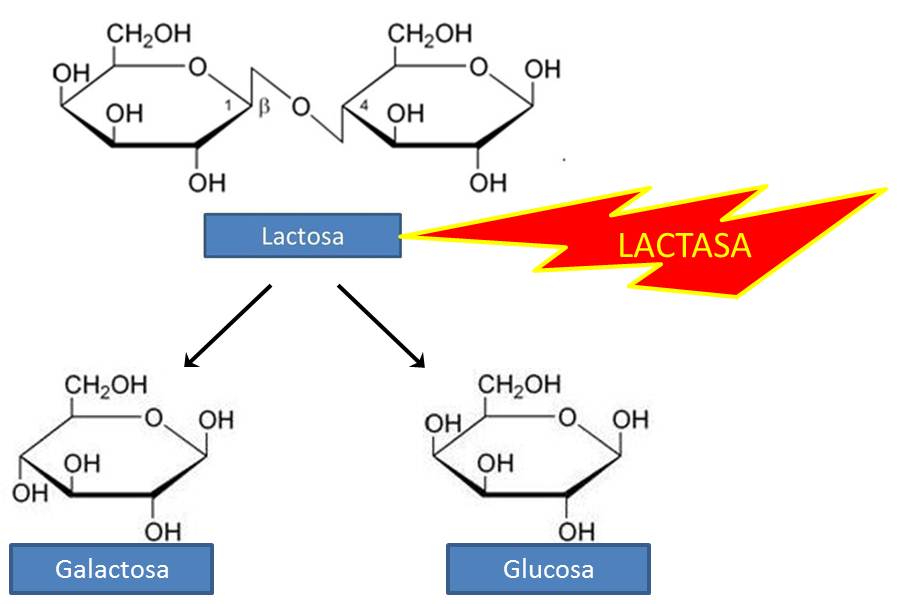
Disacáridos y otros glicósidos
El enlace glicosídico es el principal enlace estructural en todos los polímeros de los monosacáridos. Es un enlace acetal, donde el carbono anomérico de un azúcar se condensa con un alcohol, una amina o un tiol.
Polisacáridos
Con frecuencia se divide a los polisacáridos en dos clases extensas. Los homoglicanos (u homopolisacáridos) son polímeros que sólo contienen residuos de un tipo de monosacárido. Los heteroglicanos (o heteropolisacáridos) son polímeros que contienen residuos de más de un tipo de monosacárido. A diferencia de las proteínas, cuyas estructuras primarias se codifican por el genoma y tienen así longitudes específicas, los polisacáridos se forman sin una plantilla, por adición de determinados residuos de monosacárido y oligosacárido.
Almidón y glucógeno
Todas las especies sintetizan D-glucosa. El exceso de glucosa se puede descomponer y producir energía metabólica. Los residuos de glucosa se almacenan como polisacáridos, hasta que se necesitan para producir energía. El homoglicano de almacenamiento más común de la glucosa en las plantas y los hongos es el almidón; y en los animales es el glucógeno. Ambos tipos de polisacárido existen en las bacterias.
Celulosa y quitina
La glucolisis
es la principal vía metabólica de utilización de hexosas, principalmente glucosa pero también, directamente de la fructosa y de la galactosa; este proceso es común en todas las células y constituye la ruta central del catabolismo de los hidratos de carbono.
El conjunto de las reacciones de la glucolisis permiten oxidar parcialmente la glucosa, para lograr la formación de piruvato con el objetivo de liberar la energía necesaria para sintetizar ATP; esta vía se desarrolla completamete en el citoplasma celular estando en condiciones anaeróbicas o aeróbicas.
Otra de las vías metabólicas consideradas eje, es el "Ciclo de Krebs", esta ruta participa en la degradación de la mayoría de los componentes que la célula es capaz de degradar y proveen el poder reductor y los materiales de construcción, además del ATP, para todas las secuencias biosintéticas de la energía para otras actividades.

En Conclusión, los carbohidratos para la farmacología es:
Los hidratos de carbono, o carbohidratos, son claves para el funcionamiento del cuerpo,pues se encargan de proveerlo de energía. También se conocen como azúcares, ya que contienen almidón.
Cuando consumimos hidratos de carbono el cuerpo los transforma en glucosa, que es elcombustible final que emplea el organismo para realizar esfuerzos físicos, según explicaOmega Pharma Spain. Además, al igual que ocurre con los hidratos, el cuerpo también utiliza grasas y proteínas para conseguir energía.
Una persona común, que no realice especial esfuerzo físico como en el caso de los deportistas, necesita una media de entre 3 y 5g de hidratos de carbono por kg corporal. Por ello, aquellos que ronden los 70kg requieren entre 210 y 350g de HC diarios. Parapersonas cuya actividad es más intensa esta cifra aumenta.
Los hidratos de carbono se pueden dividir en diferentes grupos según una serie de parámetros. Por ejemplo, existe una diferencia entre carbohidratos rápidos y carbohidratos lentos. Los primeros aportan energía instantánea y se absorben rápidamente en la sangre, como es el caso de la maltodextrina. Sin embargo, los HC lentos necesitan más tiempopara proporcionar energía al organismo, ya que se absorben más lentamente.
Es muy importante reponerlos antes, durante y después de realizar ejercicio. El motivo es que el glucógeno muscular puede agotarse, provocando un bajón, según publica el mismo laboratorio.
Existen diferentes formas de incorporarlos al organismo. Se puede hacer mediante los alimentos o las bebidas, mientras realizamos ejercicio físico. Pero no sólo es importante hacerlo durante la actividad, sino que tenemos que reponer los niveles de HC rápidamente al finalizar.