Enzimas
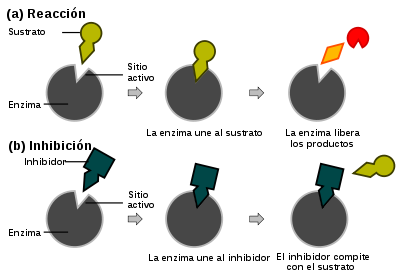
Un catalizador es una sustancia que acelera la llegada a un equilibrio. Un catalizador puede cambiar en forma temporal durante la reacción, pero no cambia en el proceso general, porque se recicla para participar en varias reacciones. Los reactivos se unen a un catalizador y los productos se disocian de él. Un catalizador no cambia la posición del equilibrio de la reacción (es decir, no hace que una reacción no favorable sea favorable).
Enzimas aplicadas en procesos industriales
''Las enzimas son proteínas especializadas capaces de acelerar la velocidad de una reacción química, promoviendo así la transformación de diferentes moléculas en productos específicos.'' |
Es indiscutible el interés que ha despertado durante las últimas décadas el uso de estos exquisitos catalizadores en diferentes procesos industriales. En gran medida, gracias a los grandes avances que ha tenido la biotecnología en áreas como la microbiología industrial, la biología molecular, la ingeniería de proteínas y la ingeniería enzimática. Estas técnicas han centrado su atención en la producción eficiente de biocatalizadores que al mismo tiempo que conserven su alta quimio-, regio- y estereoselectividad, mejoren su estabilidad, puedan ser reutilizadas y sean compatibles con tecnologías sustentables y procesos ambientalmente más limpios.
En medicina se utilizan mucho por ejemplo las enzimas pancreaticas.
Entre ellas se encuentra la PANCREOLIPASA que ayuda a mejorar la digestión de los alimentos, reemplaza las enzimas digestivas. Este medicamento se utiliza para tratar problemas de salud que causan que el cuerpo produzca una menor cantidad de estas enzimas.
Las cápsulas de liberación retardada de pancrelipase (Creon, Pancreaze, Pertzye, Ultresa, Zenpep) se utilizan para mejorar la digestión de alimentos en niños y adultos que no tienen suficientes enzimas pancreáticas (sustancias necesarias para disolver los alimentos de tal forma que puedan ser digeridos) debido a que padecen una afección que afecta el páncreas (una glándula que produce varias sustancias importantes, incluyendo las enzimas necesarias para digerir los alimentos) como fibrosis cística (una enfermedad innata que ocasiona que el cuerpo produzca una mucosidad gruesa y pegajosa que puede llegar a obstruir el páncreas, los pulmones y otras partes del cuerpo), pacreatitis crónica (inflamación del páncreas que no desaparece) u obstrucción en los conductos entre el páncreas y el intestino.
| 1,4-alpha-D- glucan glucanohydrolase |
| Fármaco: Bromelina |
| Estructura de la Bromelina |
| Molécula de la Bromelina |
| Fármaco: Papaina |
| Molécula: Enzima Papaina |
 |
| Estructura: Papaina |
 El omeprazol (5-metoxi-2-[(4-metoxi-3,5-dimetil-piridin-2-il)metilsulfinil]-3H-bencimidazol) se utiliza en el tratamiento de la dispepsia, úlcera péptica, enfermedades por reflujo gastroesofágico y el síndrome de Zollinger-Ellison. Fue inicialmente comercializado por AstraZeneca como la sal de magnesio, magnesio de omeprazol, con el nombre comercial de Losec® y Prilosec.
El omeprazol (5-metoxi-2-[(4-metoxi-3,5-dimetil-piridin-2-il)metilsulfinil]-3H-bencimidazol) se utiliza en el tratamiento de la dispepsia, úlcera péptica, enfermedades por reflujo gastroesofágico y el síndrome de Zollinger-Ellison. Fue inicialmente comercializado por AstraZeneca como la sal de magnesio, magnesio de omeprazol, con el nombre comercial de Losec® y Prilosec. |
Estructura del Omeprazol
|
Las enzimas en solución generalmente son utilizadas una sola vez debido a la dificultad que representa su recuperación al término de una reacción. Esta limitante las convierte a las enzimas en un gasto fijo e impacta directamente el costo total del proceso. Ante este panorama, una de las grandes preguntas planteadas a lo largo del desarrollo de la enzimología industrial ha sido ¿Las enzimas se pueden reutilizar eficientemente? Es claro que un biocatalizador no soluble que sea fácil de recuperar, no pierda su efectividad, se pueda reutilizar y/o permita su operación en procesos continuos a escala industrial impactará de manera positiva la economía de un proceso.
En este sentido, un gran avance en la consolidación del uso de enzimas a escala industrial se debe en gran medida al desarrollo de métodos eficientes de inmovilización de enzimas, es decir, enzimas unidas física- o químicamente a un soporte inerte lo cual permite su fácil recuperación y reutilización.
Las seis clases de enzimas
- Las oxidorreductasas catalizan las reacciones de oxidación-reducción. La mayor parte de esas enzimas se llaman, en general, deshidrogenasas.
- Las transferasas catalizan las reacciones de transferencia de un grupo y pueden necesitar la presencia de coenzimas. En las reacciones de transferencia de grupo, una parte de la molécula del sustrato se suele enlazar en forma covalente con la enzima o con su coenzima.
- Las hidrolasas catalizan hidrólisis. Son una clase especial de transferasas donde el agua sirve como aceptor del grupo transferido. La pirofosfatasa es un ejemplo sencillo de una hidrolasa.
- Las liasas catalizan la lisis de un sustrato, al generar un enlace doble; son reacciones de eliminación, no hidrolíticas y no oxidantes.
- Las Isomerasas catalizan cambios estructurales dentro de una misma molécula (reacciones de isomerización). Como estas reacciones sólo tienen un sustrato y un producto son de las reacciones enzimáticas más simples.
- Las ligasas catalizan la ligadura o unión de dos sustratos. Estas reacciones necesitan un suministro de energía potencial química de un nucleósido trifosfato, como el ATP. Las ligasas son usualmente llamadas sintetasas.
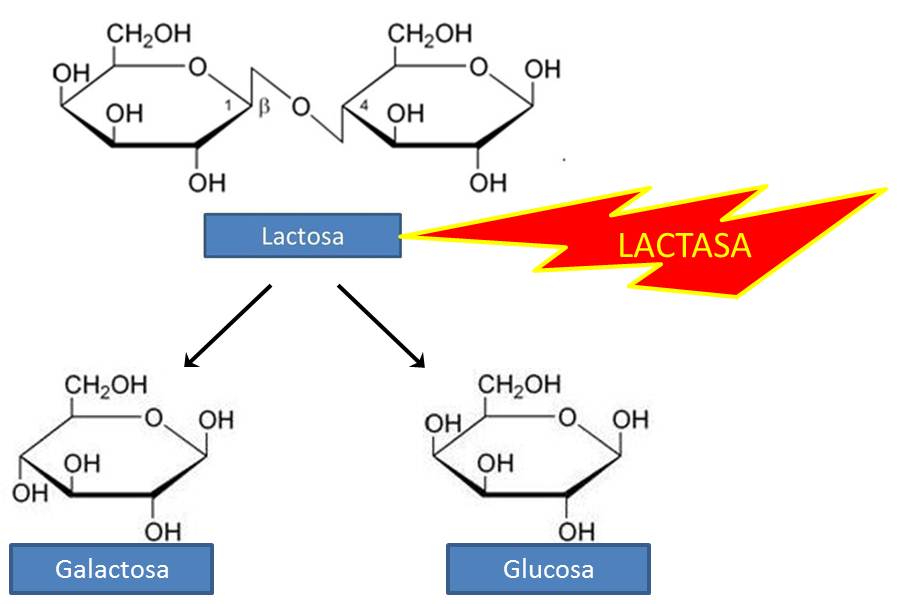
El ejemplo más conocido y actual es la leche en los mamíferos.
La LACTASA es una enzima que la mayoría de mamíferos deja de sintetizar una vez acaba la época de lactancia. En nuestro caso, la mayoría de personas tolera sin problema la leche en la edad adulta, al menos en pequeñas dosis. Sin embargo cada vez son más los casos que a partir de cierta edad la leche no sienta bien. Claramente es debido a la disminución de enzima de lactasa en el organismo, y para ello puedes adquirir en tu Farmacia enzimas digestivas que ayuden a digerirla.
Cinética química
En los experimentos cinéticos se examina la relación entre la cantidad de producto (P) que se forma en una unidad de tiempo ( [P]/ t) y las condiciones experimentales bajo las que se efectúa la reacción. La base de la mayor parte de las mediciones cinéticas es la observación de la rapidez, o velocidad (v), de una reacción, la cual varía en forma directa con la concentración de cada reactante (sección 1.4). Esta observación se expresa en una ecuación de velocidad. Por ejemplo, la ecuación de velocidad para la conversión no enzimática del sustrato (S) en el producto (P) en una reacción de isomerización, es
Ecuación de Michaelis-Menten
Las reacciones catalizadas por enzimas, como cualquier reacción química, se pueden describir en forma matemática como ecuaciones de velocidad. En ellas, varias constantes indican la eficiencia y especificidad de una enzima y en consecuencia son útiles para comparar las actividades de varias enzimas o para evaluar la importancia fisiológica de una determinada enzima. Las primeras ecuaciones de velocidad fueron deducidas a principios de 1900 examinando los efectos de variaciones en la concentración de sustrato. La figura 5.4a en la página siguiente muestra un resultado típico, donde la velocidad inicial (y 0) de una reacción es graficada en función de la concentración de sustrato ([S].
Inhibición reversible de enzimas
Un inhibidor de enzima (I) es un compuesto que se enlaza con una enzima e interfiere con su actividad. Los inhibidores pueden actuar evitando la formación del complejo ES o bloqueando la reacción química que lleva a la formación del producto. Por regla general, los inhibidores son moléculas pequeñas que se unen en forma reversible con la enzima que inhiben. Las células contienen muchos inhibidores enzimáticos naturales que juegan papeles importantes en la regulación del metabolismo. Los inhibidores artificiales se usan en experimentos para investigar los mecanismos enzimáticos y para descifrar las rutas metabólicas. Algunas medicinas y muchos venenos son inhibidores de enzimas.
Inhibición competitiva
Los inhibidores competitivos son los que se encuentran con más frecuencia en bioquímica. En la inhibición competitiva, el inhibidor sólo se puede unir a moléculas de enzima libre que no estén unidas a sustrato alguno.
Inhibición acompetitiva
Los inhibidores acompetitivos sólo se unen al ES y no a la enzima libre (figuras 5.8c y 5.11a). En la inhibición acompetitiva disminuye la Vmáx (aumenta 1/Vmáx) por conversión de algunas moléculas de E en la forma inactiva ESI.
Inhibición no competitiva
Los inhibidores no competitivos se pueden unir a la E o al ES y formar complejos inactivos EI o ESI, respectivamente. Esos inhibidores no son análogos del sustrato y no se enlazan en el mismo sitio que el S.
Inhibición enzimática irreversible
En contraste con un inhibidor enzimático reversible, un inhibidor enzimático irreversible forma un enlace covalente estable con una molécula de enzima y elimina así las moléculas del sitio activo en la población enzimática. Típicamente, la inhibición irreversible ocurre por alquilación o acilación de la cadena lateral de un residuo de aminoácido en el sitio activo.
¿COMO NOS AYUDAN LAS ENZIMAS EN LA FARMACIA MAS ESPECIFICO EN LAS FARMACOLOGÍA?
Aplicaciones y usos de las
enzimas:
En industrias farmacológicas:
 La farmacología es las ciencias que
estudia el origen, las acciones y las propiedades que las sustancias química se
ejercen sobre los organismos vivos. En un sentido más estricto, se considera la
farmacología como el estudio de los fármacos, sea que ésas tengan efectos
beneficiosos o bien tóxicos. La farmacología tiene aplicaciones clínicas cuando
las sustancias son utilizadas en el diagnóstico, prevención, tratamiento y
alivio de síntomas de una enfermedad. Aunque las posibilidades de utilización
de las enzimas en la medicina y campos relacionados sea potencialmente inversa,
en la actualidad el número concreto de aplicaciones es relativamente pequeño.
No obstante, los resultados obtenidos con este pequeño número de ideas
afortunadamente son realmente excitantes y demuestran claramente la capacidad
potencial existente en las técnicas empleadas. Puesto que las aplicaciones
médicas y farmacéuticas de las enzimas abarcan un amplio espectro de materias,
es conveniente dividirlas en tres áreas importantes de interés: terapia
enzimática, uso analítico y productos de compuestos farmacéuticos. Cada una de
estas áreas, aunque cubre un gran número de aplicaciones, presenta una serie de
principios predominantes que son esencialmente para que la utilización de las
enzimas se realice con éxito. A diferencia de otros usos industriales para las
enzimas, las aplicaciones médicas y farmacéuticas de las mismas requieren
generalmente pequeñas cantidades de enzimas muy purificadas.
La farmacología es las ciencias que
estudia el origen, las acciones y las propiedades que las sustancias química se
ejercen sobre los organismos vivos. En un sentido más estricto, se considera la
farmacología como el estudio de los fármacos, sea que ésas tengan efectos
beneficiosos o bien tóxicos. La farmacología tiene aplicaciones clínicas cuando
las sustancias son utilizadas en el diagnóstico, prevención, tratamiento y
alivio de síntomas de una enfermedad. Aunque las posibilidades de utilización
de las enzimas en la medicina y campos relacionados sea potencialmente inversa,
en la actualidad el número concreto de aplicaciones es relativamente pequeño.
No obstante, los resultados obtenidos con este pequeño número de ideas
afortunadamente son realmente excitantes y demuestran claramente la capacidad
potencial existente en las técnicas empleadas. Puesto que las aplicaciones
médicas y farmacéuticas de las enzimas abarcan un amplio espectro de materias,
es conveniente dividirlas en tres áreas importantes de interés: terapia
enzimática, uso analítico y productos de compuestos farmacéuticos. Cada una de
estas áreas, aunque cubre un gran número de aplicaciones, presenta una serie de
principios predominantes que son esencialmente para que la utilización de las
enzimas se realice con éxito. A diferencia de otros usos industriales para las
enzimas, las aplicaciones médicas y farmacéuticas de las mismas requieren
generalmente pequeñas cantidades de enzimas muy purificadas. Penicilina semisintética

Las penicilinas semisintéticas son antibióticos del grupo de los betalactámicos (concretamente penicilinas) que se obtienen mediante la modificación química de derivados de la penicilina G. Típicamente, el diseño industrial del proceso se inicia mediante la producción por fermentación de penicilina G o, en algunos casos,penicilina V; tras su purificación, se elimina la cadena lateral mediante la enzima penicilina acilasa, lo que da lugar al núcleo ácido 6-aminopenicilánico; finalmente, este compuesto se modifica químicamente para dar lugar a un antibiótico con características mejoradas. Las penicilinas semisintéticas, ampliamente utilizadas, poseen algún elemento de ventaja frente a las penicilinas naturales: estabilidad al pH ácido, resistencia a betalactamasas codificadas por plásmidos o cromosomas, espectro de acción ampliado, etc.

No hay comentarios.:
Publicar un comentario